
Literatúra
Čo hovorí o Skleróze multiplex (SM) odborná literatúra
SM sa na základe klinického priebehu rozdeľuje do nasledovných kategórií:
Relapsujúco-remitujúca forma (RRMS): približne 85 % pacientov
Ochorenie začína atakom (relapsom), po ktorom nasleduje obdobie klinickej remisie. Atak (klinicky vždy dôkaz zápalovej aktivity SM) je definovaný ako novo vzniknuté príznaky alebo výrazné zhoršenie už existujúcich príznakov (bez súvislosti s horúčkou pri infekčnom ochorení) trvajúce viac než 24 hodín. Úprava po ataku nemusí byť úplná. Do tejto podskupiny možno zaradiť aj malý počet pacientov, ktorí majú minimálnu aktivitu choroby a malý alebo žiadny neurologický deficit v priebehu až 25 rokov trvania SM. Títo pacienti majú benígnu, alebo miernu formu SM a predstavujú asi 10 – 20 % symptomatických pacientov s SM. U väčšiny pacientov s RRMS ale ochorenie neremituje, aj v obdobiach medzi atakmi je bez liečby často zaznamenaná aktivita ochorenia.
Obrázok Formy klinického priebehu SM
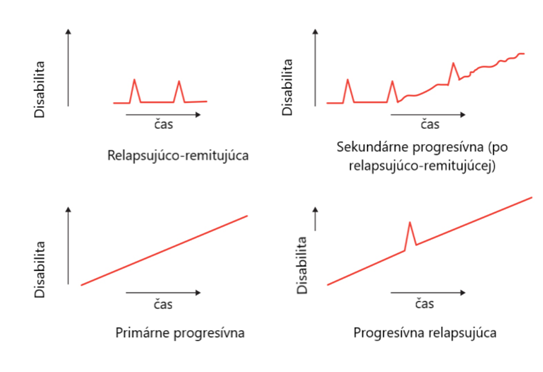
Sekundárne progresívna forma (SPMS)
s výskytom u viac než 30 % všetkých SM pacientov a je prirodzeným pokračovaním remitujúceho štádia SM, pri ktorom sa v priebehu 5. – 15. roku jeho trvania začína choroba zhoršovať. Po 10 rokoch 50 % a po 20 – 25 rokoch najmenej 80 % neliečených pacientov s RRSM prejde do tejto formy ochorenia.
Primárne progresívna SM (PPMS)
bez atakov, postihuje približne 10 % pacientov. Táto forma SM je častejšia u mužov a dominujúcim klinickým príznakom je spastická paraparéza dolných končatín.
Progresívna relapsujúca SM (PRMS)
Vyskytuje sa u 5 % pacientov, je snáď najhoršou klinickou formou ochorenia. Postupný vývoj deteriorácie od začiatku ochorenia, zhoršovaný ešte výskytom relapsov pacienta veľmi rýchlo invalidizuje.
Klinicky izolovaný syndróm (CIS)
jediná klinická epizóda neurologických príznakov.
Rádiologicky izolovaný syndróm (RIS)
je prítomnosť lézií na MRI zobrazení mozgu charakteristických pre SM u pacienta, ktorý nemal žiadne klinické ťažkosti konzistetné s SM (Klimová E, 2006).
V 2014 (Lublin et al. 2014) bolo publikované nové rozdelenie phenotypizácie SM, ktoré okrem klinického priebehu do klasifikácie zahŕňa MR obraz ochorenia, teda prítomnosť alebo neprítomnosť aktívnych lézií na MR vyšetrení. Cieľom nového rozdelenia bola lepšia kategorizácia pacientov na základe aktivity ochorenia, nové delenie upresňuje štádium ochorenia a preferuje sa v klinických štúdiách.
Aktivita ochorenia sa definuje ako klinické relapsy a/alebo MRI lézie (gadolinium-enhánsujúce, nové/zväčšujúce sa T2 lézie).
I pri relasujúco – remitujúcej forme SM zápal väčšinou pokračuje bez príznakov a dá sa zistiť len pomocou MR vyšetrenia.
Strava základ všetkého ?
Údaje zo 40. rokov 20. storočia ukazujú, že incidencia SM počas 2. svetovej vojny poklesla a po vojne opäť stúpla. Výskum sa zameral na možnú súvislosť zmeny stravovania sa počas prídelového systému (spotreba masla, syra a mäsa bola limitovaná) s incidenciou a priebehom SM. Dve štúdie publikované krátko po 2. svetovej vojne poukázali na možný súvis medzi výskytom SM a príjmom saturovaných tukov v Nórsku (Swank 1950, Swank 1952)
Swank následne dlhodobo sledoval súbor pacientov s SM, ktorí dodržiavali nízky príjem saturovaných tukov a pravidelne publikoval svoje výsledky v medicínskych časopisoch. (Swank a Dugan 1990). Sledoval súbor pacientov mnoho rokov a jeho výsledky s nízkou mortalitou a morbiditou pacientov, ktorí dodržiavali prísnu diétu, sú bezprecedentné v medicínskej literatúre a zostávajú obrovskou inšpiráciou pre mnohých lekárov a pacientov ako Swankova diéta s nízkym obsahom saturovaných tukov. Swank radil svojim pacientom neprekročiť denný príjem SFA nad 20 gramov denne, týmto dramaticky zredukoval ich priemerný príjem z predchádzajúceho priemerného príjmu 125 gramov denne (Swank a Goodwin 2003). Najlepšie výsledky boli dosiahnuté u pacientov s minimálnym stupňom neurologického postihnutia na začiatku diéty, ktorých priemerný príjem SFA neprekročil 17 gramov denne, ale diéta mala priaznivý vplyv tiež u pacientov s vyšším stupňom neurologického postihnutia.
Výsledky jeho 34 rokov trvajúcej štúdie publikovanej v časopise Lancet v r. 1990 zostávajú najefektívnejšou liečbou SM, ktorá kedy bola publikovaná v recenzovanej literatúre (Kadoch 2012)
Významná redukcia saturovaných tukov podľa Swanka a nulová tolerancia stužených tukov tvorí i základ dnes veľmi rozšírenej OMS (Overcoming Multiple Sclerosis) diéty propagovanej austrálskym lekárom Georgom Jelínkom (Jelinek, 2010).
Obrázok – Vplyv množstva denného príjmu saturovaného tuku na mortalitu pacientov so SM
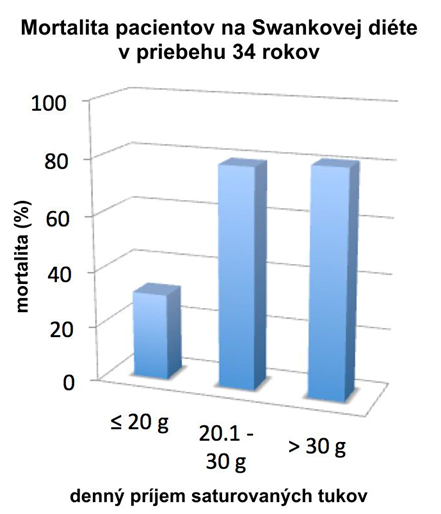
Upravené podľa: Swank RL, Dugan BB: Effect of low saturated fat diet in early and late cases of multiple sclerosis, The Lancet 1990, 336:37-39 (54)
Ďalšie štúdie sú neporovnateľne kratšieho trvania s menšími počtami pacientov:
Malá randomizovaná štúdia (n= 32) sledovala počas 12 mesiacov vplyv diéty založenej na čisto rastlinnej strave s nízkym obsahom tukov na progresiu SM, nepreukázala významný vplyv na EDSS alebo rádiologické ukazovatele ochorenia, u pacientov sa dosiahla redukcia hmotnosti, únavy, LDL a celkového cholesterolu. Priaznivý efekt na zníženie únavy však mohol byť dosiahnutý znížením hmotnosti. Navyše porovnávané skupiny boli štatisticky odlišné v EDSS a MRI aktivite, nábor pacientov nebol zaslepený. (Yadav et al. 2015)
Iná štúdia vplyvu nízkotukovej diéty so suplementáciou rybím olejom zredukovala príjem SFA na 15 % kalorickej spotreby, čo predstavuje redukciu na 30-50 g SFA v závislosti od telesnej hmotnosti. Štúdia zaznamenala priaznivý efekt pre pacientov s RRSM v oblastiach ako sú fyzická kondícia, kvalita života a únava. (Weinstock-Guttman etal. 2005)
Keďže randomizované kontrolované štúdie sledujúce vplyv diéty sú prakticky neuskutočniteľné, máme viac informácií z epidemiologických a prípadových kontrolných štúdií.
Existuje epidemiologická štúdia skúmajúca súvis medzi mortalitou v dôsledku SM a rôznymi enviromentálnymi faktormi v rokoch 1983-1989 v 36 krajinách. Príjem saturovaných tukov, tukov živočíšneho pôvodu a zemepisná šírka nezávisle a pozitívne korelovali s mortalitou na SM (Esparza et al. 1995).
Ghadirian (1998) v prípadovej štúdii poukázal na súvislosť medzi BMI a rizikom SM. Riziko bolo tiež vyššie s vyššou spotrebou živočíšnych tukov. Naopak, protektívny vplyv sa pozoroval zvýšenou konzumáciou zeleniny, vlákniny, cereálií/chleba, ovocných štiav, vitamínu C, thiamínu, riboflavínu, kalcia a magnézia.
Štúdia skúmajúca amerických veteránov pozitívne asociovala výskyt SM u vojakov pochádzajúcich z lepších sociálnych pomerov, s lepším stupňom výživy a vyššou spotrebou mäsa, tiež s diétou obsahujúcou menej rýb a viac mliečnych produktov (Lauer et al. 1994).
Nedávna štúdia našla protektívny efekt konzumácie n-3 PUFA na výskyt CIS. Riziko nebolo zvýšené konzumáciou iných druhov tuku (Hoare et al. 2015).
V štúdii založenej na internetovom dotazníku skúmajúceho diétne zvyky 2469 pacientov so SM Jelinek našiel pozitívnu asociáciu konzumácie ovocia, zeleniny a zdravých tukov s lepšou kvalitou života a menšou mierou progresie postihnutia. (Hadgkiss et al. 2015)
Nedávna pediatrická štúdia hodnotila dotazníkovou metódou vplyv rôznych skupín makronutrientov u detských pacientov s SM z 11 centier v USA (n=219). Výsledky ukázali, že každé zvýšenie konzumácie tukov o 10 % malo za následok 56% zvýšenie rizika relapsu, každé zvýšenie konzumácie saturovaných tukov o 10% zvýšilo riziko relapsu o 237%. Naopak, každý pohár skonzumovanej zeleniny bol asociovaný s 50% znížením rizika relapsu. (Azary et al 2017)
Recentná štúdia hodnotila asociáciu medzi príjmom špecifických potravín a disabilitou u pacientov s SM. Analýza podrobných dotazníkov charakterizujúcich diétu takmer 7000 pacientov poukázala na to, že diéta s vyšším príjmom ovocia a zeleniny, strukovín a celozrnných potravín a s nižším príjmom sladkostí, sladených nápojov a červeného mäsa bola asociovaná s nižším stupňom zneschopnenia (Fitzgerald et al. 2018).
Polynenasýtené mastné kyseliny (PUFA)
Kyselina linolová (LA) patrí medzi n6-PUFA a je esenciálnou mastnou kyselinou. Tvorí približne 50 % konzumovaných rastlinných olejov v západných krajinách. Mnoho rokov je známe, že LA redukuje krvný cholesterol, a že náhradou SFA za LA sa znižuje riziko kardiovaskulárnych chorôb.
V metaanalýze (Johnson a Fritshe 2012) štúdií skúmajúcich prozápalový efekt LA nebola pozitívna ani jedna štúdia, a teda nebol potvrdený súvis medzi príjmom LA a zvýšením zápalových markerov v sére. Mnohokrát konzumácia LA mala protizápalový účinok. V randomizovanej štúdii u obéznych subjektov zvýšenie príjmu LA zo 4 % na 13% znížilo zápalové biomarkery. (Fritsche et al. 2015)
Máme veľa štúdií o potenciálnom benefite zvýšenia príjmu omega-3mastných kyselín (n–3 PUFAs), ktoré priaznivo pôsobia na kardiovaskulárny systém a všeobecne majú protizápalový účinok.
Potenciálny priaznivý účinok rybieho oleja na ľudské zdravie sa skúma od 50-tych rokov, po zistení, že populácie Eskimákov mali nízke riziko vzniku kardiovaskulárnych ochorení napriek vysokému príjmu tukov v strave. Zistilo sa, že rybí tuk obsahuje vysoký podiel PUFA, zvlášť n-3 PUFA. Niektoré skoršie štúdie popísali priaznivý vplyv konzumácie rybieho oleja na priebeh atopického ekzému, hypercholesterolémie a artritídy. Mechanizmus priaznivého protizápalového účinku n-3 PUFA a n-6 PUFA po ich inkorporácii do fosfolipidových membrán je pravdepodobne cestou produkcie eikozanoidov a prostaglandínov, ktoré regulujú zápal, agregáciu krvných doštičiek a vazokonstrikciu. (Riediger et al. 2009) Omega-3 PUFA ako súčasť fosfolipidových membrán ovplyvňujú funkciu iontových kanálov kardiomyocytov, β adrenergných a iných receptorov a zvyšujú fluiditu bunkových membrán (Rimm et al. 2018).
Štúdie s laboratórnymi zvieratami
Máme niekoľko štúdií skúmajúcich vplyv diétnych intervencií u experimentálnej alergickej encefalitídy (EAE), experimentálneho modelu SM. Podávanie kyseliny linolovej (Hughes etal. 1980), PUFA (Harbige etal. 2000) a sezamového oleja (Mosaiyebi etal. 2007) bolo asociované s menej závažným priebehom EAE, diéta s vysokým obsahom saturovaného tuku naopak, mala nepriaznivý vplyv na priebeh ochorenia u experimentálnych zvierat. (Timmermans et al. 2014) Zaujímavý je i vplyv kalorickej reštrikcie na priebeh EAE.
Kalorická reštrikcia mala priaznivý efekt na priebeh ochorenia a to do takej miery, že laboratórne zvieratá v skupine prísnej kalorickej reštrikcie (66% zníženie kalorického príjmu) vôbec nepreukazovali známky ochorenia. (Esquifino et al. 2007, Choi et al. 2016)
Klinické štúdie s PUFA
Už klasické štúdie suplementácie polynenasýtenými mastnými kyselinami prebehli v 70-tych rokoch minulého storočia. Štúdia porovnávajúca vplyv suplementácie PUFA vs MUFA na priebeh ochorenia SM (denná suplementácia 8,6 gramov kyseliny linolovej vo forme emulzie slnečnicového oleja vs 3,8 gramov kyseliny olejovej v olivovom oleji) počas jedného roka nepreukázala rozdiel v EDSS, ale skupina dostávajúca PUFA mala menej atakov (Millar et al. 1973)
Podobná štúdia (Bates et al. 1978) porovnávala vysokú a nižšiu dávku PUFA s nižšími a vyššími dávkami MUFA, znovu sa nepreukázal vplyv na EDSS, skupina pacientov dostávajúca PUFA mala menej závažné ataky.
Štúdia porovnávajúca efekt suplementácie n-3 PUFA (vo forme kapsúl s rybím olejom – v dávke 1,71 gramov denne EPA a 1,41 gramov denne DHA oproti placebu (kapsule s olivovým olejom). Obe skupiny pacientov boli inštruované, aby znížili príjem živočíšnych tukov a zvýšili príjem n-6 PUFA. Štúdia nedosiahla štatisticky významný rozdiel v EDSS po 2 rokoch, v skupine s n-3 PUFA sa ale pozoroval trend zlepšenia v sledovaných parametroch ochorenia. (Bates et al. 1989)
Šestnásť pacientov s RRSM dostávalo rybí olej obsahujúci DHA a EPA po dobu 2 rokov. Pacienti boli tiež inštruovaní, aby redukovali príjem saturovaných tukov a zvýšili spotrebu rýb. Po 2 rokoch autori zaznamenali významné zníženie počtu atakov a EDSS v porovnaní s východiskovými hodnotami (Nordwick et al. 2000).
Torkildsen (Torkildsen et al. 2012) v randomizovanej, placebom kontrolovanej štúdii nepreukázal žiadny efekt suplementácie omega-3 PUFA na EDSS po 2 rokoch.
Suplementácia rybím olejom (4g denne oproti placebu) po dobu 1 roka bola bez efektu na EDSS alebo počet atakov, v liečenej skupine ale autori zaznamenali signifikantné zníženie prozápalových mediátorov (Ramirez et al. 2013)
Štúdia založená na internetových dotazníkoch vyplnených veľkým počtom pacientov s SM (n=2469), u ktorých sa retrospektívne zaznamenala konzumácia rýb, rybieho oleja, omega-3 FA, ľanového oleja za posledných 12 mesiacov, ukázala trend nižšieho počtu relapsov a nižšej aktivity ochorenia u pacientov konzumujúcich ryby, efekt bol jasne závislý od množstva skonzumovaných rýb. Suplementácia ľanovým olejom (n-3 PUFA) bola asociovaná s vyše 60% znížením počtu relapsov (Jelinek et al. 2013).